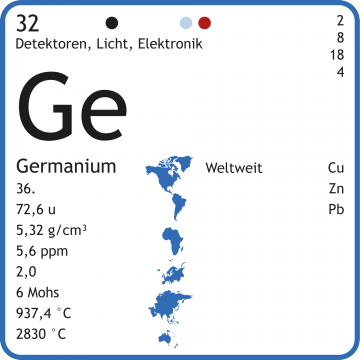
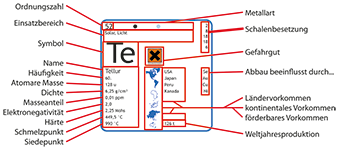
Germanium-Chemie » Verbindungen
Germanium tritt in seinen Verbindungen sowohl II- als auch IV-wertig auf. Die höhere Beständigkeit weisen dabei die IV-wertigen Moleküle auf. Interessant ist der Aufbau seiner Wasserstoffverbindungen, die analog zu den einfachen gesättigten Kohlenwasserstoffen aufgebaut sind. Das Germanium nimmt hierbei die Rolle des Kohlenstoffatoms ein, welches ebenfalls vierwertige Verbindungen aufbaut. GeH4 ist gasförmig und wird als Monogerman bezeichnet. In der Kohlenstoffchemie wäre sein analoges Molekül das Methan. Monogerman oder auch Germaniumhydrid (GeH4) wird in der Halbleiterindustrie zur Epitaxie und zum Dotieren verwendet.
Die Wasserstoffverbindungen des Germaniums, die eine homologe Reihe verschieden langer Kettenmoleküle bilden, werden Germane genannt.Bei Raumtemperatur flüssig sind die folgenden Verbindungen: Ge2H6 wird Digerman genannt und Ge3H8 nennt man Trigerman.
Zudem existieren zwei feste, ungesättigte Verbindungen des Molekülaufbaus (GeH2)x, sie sind gelblich und werden als Polygermen bezeichnet. Verbindungen des Typs (GeH)x werden als Polygermine bezeichnet. Sie sind dunkelbraun. Die Stoffe sind hochmolekular und selbstentzündlich.
Von den Germaniumhalogeniden sind ebenfalls Ge(II)- u. Ge(IV)-Verbindungen bekannt. Germaniumtetrachlorid, (GeCl4) ist eine Flüssigkeit mit einem Siedepunkt von nur 83 °C und bildet sich bei Einwirkung von Chlorwasserstoff, also Salzsäure auf Germaniumoxide aus. Es ist ein wichtiges Zwischenprodukt bei der Germanium-Gewinnung. Hochreines GeCl4 wird bei der Herstellung von Lichtwellenleitern aus Quarzglas eingesetzt, um auf der Innenseite der Quarzfasern eine hochreine Germanium(IV)-oxid Schicht zu erzeugen.
Zur Erzeugung von hochreinen Germaniumschichten kann auch die Disproportionierung von Germanium(II)-jodid unter Bildung von Germanium und Germanium(IV)-jodid eingesetzt werden. Das Germaniumtetrajodid ist orangefarben. Germaniumhalogenide besitzen stark unterschiedliche Schmelz- und Kochpunkte.
Germaniumtetrajodid schmilzt bei 114 °C und wird bei 348 °C gasförmig.
Germaniumtetrabromid schmilzt bei 26,1 °C und wird bei 186,5 °C gasförmig.
Die beiden Verbindungen zersetzen sich in Wasser. Wohingegen das gasförmige Germaniumtetraflourid ein beständiges Hydrat bildet.
Germaniumdioxid ist ein weißes Pulver, welches erst bei 1115 °C schmilzt und welches beim Verbrennen von Germanium entsteht. Es löst sich leicht in Laugen auf, wobei sich die Germanate bilden. In fast allen Germanium-haltigen Mineralien liegt das Germanium als Germanat vor.